


Определение содержания ионов железа в растворе травления
Объект испытания: Растворы травления
Метод измерения: Потенциометрическое окислительно-восстановительное титрование
Прибор: Автоматический потенциометрический титратор АТ-710В/S/M -10 со стандартным предусилителем
Электроды: Комбинированный платиновый электрод C-272 (внутренний раствор - 3,3 М водный раствор KCl).
Титрант: 0,02М водный раствор перманганата калия (KMnO4).
Дополнительный реактив: Реагент Зиммерманна-Рейнхардта - смесь сульфата марганца (II), серной и фосфорной кислот.
1. Область применения и терминология
Ион железа (Fe2+) в растворе травления определяли методом окислительно-восстановительного титрования. Реагент Зиммерманна-Рейнхардта добавляли к пробе анализируемого образца и затем полученный раствор титровали 0,02 М раствором перманганата калия (KMnO4). Конечная точка титрования (КТТ) определялась по точке перегиба кривой титрования. Концентрация Fe2+ рассчитывалась по объему раствора KMnO4, затраченного на титрование до КТТ.
Окислительно - восстановительная реакция Fe2+ и KMnO4.
Fe2+ + MnO4- + 8 H+ → 5 Fe3+ + Mn2+ + 4 H2O
Если в анализируемом растворе присутствует соляная кислота, то часть 0,02 М раствора KMnO4 расходуется на реакцию окисления хлорид-иона до хлора, что приводит к получению завышенных результатов и ошибке измерения. Для предотвращения влияния хлорид-иона на результаты титрования, в пробу раствора травления добавляют реактив Циммерманна-Рейнхардта, содержащий ион марганца Mn2+.
2. Примечания
Работа с вышеуказанными веществами должна выполняться в хорошо проветриваемом помещении или вытяжном шкафу.
3. Процедуры после титрования
Промойте электрод чистой водой, а затем держите его в чистой воде, чтобы не высушить жидкое соединение этого.
4. Процедура определения ионов двухвалентного железа в растворе травления
Подготовка реагента Циммерманна-Рейнхардта
1) Добавьте 90 г пентагидрата сульфата марганца (II) (MnSO4×5H2O) в химический стакан объемом 1000 см3.
2) Добавьте 200 см3 дистиллированной воды для растворения MnSO4×5H2O.
3) Осторожно и медленно добавьте в стакан 175 см3 фосфорной кислоты и 350 см3 серной кислоты (1 + 1). *
4) Добавьте чистую воду, пока общее количество раствора не станет 1л.
* При добавлении фосфорной и серной кислоты (1 + 1) происходит нагрев раствора, поэтому кислоты нужно добавлять маленькими порциями при охлаждении раствора.
Холостой опыт (бланк)
1) В стакан емкостью 200 см3 добавьте 5 см3 чистой воды.
2) Добавьте 70 см3 чистой воды и 30 см3 реагента Циммермана-Рейнхардта.
3) Титруйте 0,02 М водным раствором KMnO4 для измерения уровня холостого опыта (бланка).
Измерение
1) В стакан емкостью 200 см3 добавьте 5 см3 10-кратно разведенной пробы образца.
2) Добавьте 70 см3 чистой воды и 30 см3 реагента Циммермана-Рейнхардта.
3) Титруйте 0,02 М водным раствором KMnO4 до КТТ.
5. Расчет
Fe2+ (г /дм3) = (EP1 - BL1) × TF × C1 / (R × S)
EP1: расход титранта (см3)
BL1: расход титранта для холостого титрования = 0,0000 см3
TF: коэффициент титранта = 1,0195
C1: коэффициент пересчета концентрации = 5,585 мг/см3.
R : коэффициент разбавления = 0,1
S: объем разбавленной пробы (см3)
Параметры титрования

Пример кривой титрования и полученных результатов
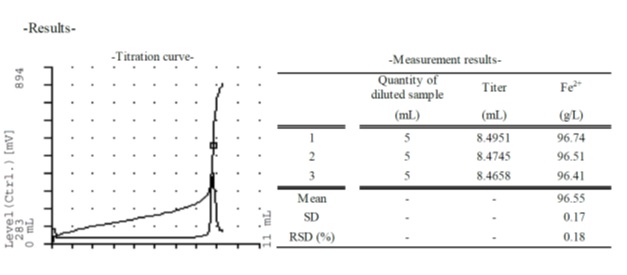
6. Резюме
Результаты титрования показали хорошую повторяемость с ОСО (относительное стандартное отклонение), равным 0,18%

